Rabu, 27 Maret 2013
Hidrokarbon
Hidrokarbon yang paling sederhana adalah alkana, yaitu hidrokarbon yang
hanya mengandung ikatan kovalen tunggal. Hidrokarbon merupakan senyawa
yang struktur molekulnya terdiri dari hidrogen dan karbon. Molekul yang
paling sederhana dari alkana adalah metana. Metana berupa gas pada suhu
dan tekanan baku, merupakan komponen utama gas alam (Wilbraham, 1992).
Hidrokarbon dapat diklasifikasikan menurut macam-macam ikatan karbon yang dikandungnya. Hidrokarbon dengan karbon-karbon yang mempunyai satu ikatan dinamakan hidrokarbon jenuh. Hidrokarbon dengan dua atau lebih atom karbon yang mempunyai ikatan rangkap dua atau tiga dinamakan hidrokarbon tidak jenuh (Fessenden, 1997).
Hidrogen dan senyawa turunannya, umumnya terbagi menjadi tiga kelompok besar yaitu:
1. Hidrogen alifatik terdiri atas rantai karbon yang tidak mencakup bangun siklik. Golongan ini sering disebut sebagai hidrokarbon rantai terbuka atau hidrokarbon siklik. Contoh hidrokarbon alifatik yaitu :
C2H6 (etana) CH3CH2CH2CH2CH3 (pentana)
2. Hidrokarbon alisiklik atau hidrokarbon siklik terdiri atas atom karbon yang tersusun dalam satu lingkar atau lebih.
3. Hidrokarbon aromatik merupakan golongan khusus senyawa siklik yang biasanya digambarkan sebagai lingkar enam dengan ikatan tunggal dan ikatan rangkap bersilih–ganti. Kelompok ini digolongkan terpisah dari hidrokarbon asiklik dan alifatik karena sifat fisika dan kimianya yang khas (Syukri, 1999).
Sebagai hidrokarbon jenuh, semua atom karbon dalam alkana mempunyai empat ikatan tunggal dan tidak ada pasangan elektron bebas. Semua elektron terikat kuat oleh kedua atom. Akibatnya, senyawa ini cukup stabil dan disebut juga parafin yang berarti kurang reaktif (Wilbraham, 1992).
Karbon-karbon dari suatu hidrokarbon dapat bersatu sebagai suatu rantai atau suatu cincin. Hidrokarbon jenuh dengan atom-atomnya bersatu dalam suatu rantai lurus atau rantai yang bercabang diklasifikasikan sebagai alkana. Suatu rantai lurus berarti dari tiap atom karbon dari alkana akan terikat pada tidak lebih dari dua atom karbon lain. Suatu rantai cabang alkana mengandung paling sedikit sebuah atom karbon yang terikat pada tiga atau lebih atom karbon lain (Fessenden, 1997).
Alkana rantai lurus:
CH3 – CH2 - CH3
Alkana rantai cabang :
CH3 – CH – CH2 – CH3
CH3
Senyawa berbobot molekul rendah berwujud gas dan cair, dan zat yang berbobot molekul tinggi berwujud padat. Alkana merupakan zat nonpolar, zat yang tak larut dalam air dengan kerapatan zat cair kurang dari 1,0 g/ml. Selain alkana juga ada alkena yaitu hidrokarbon yang memiliki satu atau lebih ikatan rangkap dua karbon–karbon. Senyawa ini dikatakan tidak jenuh karena tidak mempunyai jumlah maksimum atom yang sebetulnya dapat ditampung oleh setiap karbon (Pettruci, 1987).
Hidrokarbon alifatik berasal dari minyak bumi sedangkan hidrokarbon aromatik dari batu bara. Semua hidrokarbon, alifatik dan aromatik mempunyai tiga sifat umum, yaitu tidak larut dalam air, lebih ringan dibanding air dan terbakar di udara (Wilbraham, 1992)
Alkana yang merupkan hidrokarbon tak jenuh yang berasal dari aldehid dapat direaksikan dengan asetaldehid, logam Zn dan dalam suasana asam ditambahkan H2SO4, setelah dilakukannya penambahan H2SO4 maka terjadi perubahan warna berubah menjadi coklat kehitaman, pekat logam Zn yang adapun menjadi larut akibat pengaruh H2SO4. Reaksi ini dinamakan Reduksi Clemensen, adapun reaksinya sebagai berikut:
O
CH3 – C – H Zn + H2SO4 C2H6
Logam Zn disini berfungsi sebagai reduktor, sedangkan H2SO4 pekat berfungsi sebagai oksidator. Hal inilah yang menyebabkan terjadinya perubahan warna. Asetaldehid merupakan golongan dari aldehid yang mudah tereduksi menjadi senyawa dengan jumlah atom yang sama banyaknya. Logam Zn yang ditambahkan berfungsi sebagai reduktor (mengalami oksidasi), sedangkan larutan H2SO4 pekat sebagai oksidator (mengalami reduksi).
misi gas yang mempunyai pengaruh terhadap kesehatan manusia dan juga pemanasan global seringkali tidak merupakan prioritas dalam setiap kebijakan yang dibuat oleh banyak negara di dunia. Sebenarnya seberapa parahkah akibat yang ditimbulkan emisi gas ini dapat kita telusuri berikut ini.
Sejatinya, emisi gas yang berasal dari hasil bakaran dalam kegiatan manusia merupakan konsekuensi kehidupan sehari-hari di planet bumi ini. Emisi gas yang terjadi, pun bukan semata-mata berasal dari kegiatan manusia, tapi juga dari proses alami. Misalnya, pada pernafasan daun, letusan gunung berapi, proses kehidupan alamiah di hutan, kebakaran spontan dalam hutan, dan proses biokimia yang terjadi di rawa. Gas yang diemisikan secara alami ini, menurut Dr. dr. Rachmadhi Purwaka SKM dari Fakultas Kesehatan Masyarakat Universitas Indonesia, Jakarta, merupakan bagian dari proses daur ulang yang selalu terjadi secara dinamik dalam rangka menuju keseimbangan alamiah.
“Selama jumlah emisi gas hasil bakaran itu masih dalam batas-batas kesanggupan alam mendaur-ulangkan kembali, emisi gas tidak akan mengganggu secara nyata kehidupan di bumi. Namun, apabila peningkatan gas akibat kegiatan manusia telah melampau kepasitas daur ulang alami, tentu saja menyebabkan penumpukan gas, tidak hanya pada lingkungan mikro, tetapi juga telah menyebabkan goyahnya keseimbangan lingkungan makro, di antaranya dalam bentuk pemanasan global yang secara tidak langsung berakibat pada kesehatan masyarakat,” ungkap Rachmadhi.
Di samping efek gas yang tidak langsung itu, jenis-jenis kandungan gas emisi itu pun berpotensi menimbulkan akibat secara langsung terhadap kesehatan masyarakat.
Kehadiran beberapa komponen gas emisi yang terbentuk dari kendaraan bermotor (gas karbon monoksida, gas nitrogen, dan gas gas-gas nitrogen oksida, serta gas-hidrokarbon) dan ini merupakan bahan xenobiotic (zat asing bagi tubuh manusia), juga menimbulkan berbagai macam gangguan kesehatan pada manusia secara langsung. Karbon monoksida, misalnya, akan menimbulkan gangguan pada sistem pengangkutan oksigen dalam tubuh. Gas-gas nitrogen oksida merupakan gas yang berpotensi menurunkan imunitas tubuh, dan gas-gas hidrokarbon, jelas dapat menimbulkan iritasi, gangguan sistem tubuh dan kanker.
Pemanasan Global
Menurut Rachmadhi, pemanasan global mulai disadari ketika kira-kira pada dekade 1960-an sampai 1970-an, para ahli dihadapkan dengan data mengenai terhentinya pendinginan udara. Sebelumnya, bumi mengalami pendinginan dengan laju setengah derajat setiap tahunnya. Tetapi, proses pemanasan global yang ketika itu terdeteksi di belahan bumi bagian utara, menyebabkan proses pendinginan bumi terhenti. Sejak itu, kondisi ini berlanjut dengan pemanasan global yang menjurus kepada peningkatan suhu udara.
Para ahli yang tergabung dalam badan the National Oceanographic and Atmospheric Administration di Amerika Serikat, lalu percaya bahwa pemanasan global terjadi akibat penumpukan gas karbon dioksida di atmosfir lapisan atas sebagai hasil bakaran dalam kegiatan manusia. Kehadiran gas karbon dioksida dalam jumlah yang banyak ini seakan menjadi peredam bagi albedo atau derajat refleksi bumi terhadap sinar matahari yang memungkinkan bumi terhindar dari panas yang berlebihan. Refleksi bumi terhadap sinar matahari itu terjadi karena pemantulan sinar matahari oleh partikel-partikel debu, awan, permukaan air, hamparan salju, dan es.
Di samping gas karbon dioksida, beberapa gas lain juga diketahui turut dalam pemanasan global itu. Gas-gas yang dimaksud, antara lain, gas ozon yang terdapat pada atmosfir lapisan bawah, gas metana, gas-gas klorofluorokarbon, gas-gas nitrogen oksida, dan uap air. Awan yang merupakan penangkis sinar matahari pemanas bumi, ternyata juga menghalangi pelepasan panas yang dipantulkan bumi sehingga turut berperan dalam proses pemanasan global.
Menurut Rachmadhi, diketahui bahwa karbon dioksida mempunyai kontribusi terbesar dalam pengaruhnya terhadap pemanasan global, yaitu sebanyak 49 persen, sedangkan gas metana hanya 18 persen, gas-gas klorofluorokarbon 14 persen, gas-gas nitrogen oksida 6 persen, dan gas-gas lainnya sebesar 13 persen. Dengan demikian, dapat dikatakan bahwa dari segala macam gas penyebab terjadinya pemanasan global, gas karbon dioksida merupakan gas yang paling membahayakan. Sebaliknya, pemanasan global oleh gas karbon dioksida melalui greenhouse effect itu, merupakan prakondisi bagi kehidupan manusia dan kebanyakan hewan. Seandainya proses ini tidak terjadi, suhu rata-rata udara di permukaan bumi adalah minus 20 derajat Celcius.
Namun, dalam periode waktu belakangan ini, bumi mendapat pasokan berlebihan gas-gas itu. Pembakaran hutan dan bahan bakar fosil, kegiatan industri, pembangkit tenaga, dan emisi kendaraan bermotor mengkontribusikan gas karbon dioksida dan gas-gas lainnya ke atmosfir. “Pemasokan gas-gas ini terjadi secara berlebihan dan terkonsentrasi pada tempat-tempat tertentu”, tegasnya.
Akibat Adanya Peningkatan Jumlah Manusia dan Pembangunan
Peningkatan jumlah manusia dan aselerasi pembangunan yang mengiringinya, menimbulkan tuntutan tersedianya bahan pangan yang berlipat-lipat kali banyak dibanding masa-masa lalu. Pola bercocok tanam tradisional tidak sanggup lagi memenuhi desakan kebutuhan pangan dunia, sehingga pola pertanian mengalami revolusi yang memaksa terjadinya penebasan hutan untuk keperluan lahan bercocok tanam dan tempat hunian.
Dengan pembukaan lahan pertanian yang menyebabkan dibongkarnya hutan penyerap gas karbon dioksida melalui proses asimilasi, peningkatan kadar gas karbon dioksida di atmosfir menjadi lebih tak terkendali. Dalam keadaan biasa hutan dan tumbuhan pada umumnya merupakan salah satu unsur yang berperan mentranformasikan gas karbon dioksida menjadi bahan-bahan keperluan pertumbuhan bagi tanaman dalam daur-ulang karbon. “Menurut perkiraan, bila kondisi lain mendukung, diperlukan tanaman 20 milyar pohon setiap tahun untuk dapat menyerap 67 persen emisi tahunan gas karbondioksida di Amerika Serikat,” katanya.
Di samping karbon dioksida, gas-gas klorofluorokarbon, yang merupakan kelompok gas buatan manusia, juga mempunyai pengaruh terhadap dalam pemanasan global. Gas-gas klorofluorokarbon bukan merupakan emisi gas hasil bakaran kegiatan manusia. Kelompok gas ini dibuat untuk beberapa keperluan, di antaranya, sebagai bahan pendingin (diklorodifluorometana atau freon), bahan pelarut dalam industri, bahan pencuci komponen elektronik, bahan tambahan pada cat yang mudah menguap, bahan pembuatan karet busa plastik (karet busa poliuretana), dan tabung semprot aerosol. “Walaupun jumlah gas klorofluorokarbon jauh lebih sedikit daripada jumlah gas karbon dioksida, setiap molekul gas klorofluorokarbon berpotensi menimbulkan greenhouse effect sebesar 10 ribu kali dibandingkan dengan molekul gas karbon dioksida,” tegasnya.
Sekali masuk ke atmosfer, gas klorofluorokarbon dapat bertahan antara 75 tahun sampai dengan 110 tahun. Sementara berada di sana, gas ini akan beraksi melenyapkan gas ozon perisai pelindung bumi terhadap sinar matahari berlebihan. Akibat kelebihan sinar matahari ini berpengaruh terhadap timbulnya perubahan-perubahan pada iklim, kehidupan satwa dan flora. Fitoplankton dan algae bahan makanan untuk ikan dimatikan oleh sinar matahari berlebih ini. Akibatnya, penyerapan gas kardon dioksida oleh banyaknya flora air yang mati ini pun turut berkurang.
Pemanasan global berlebihan merupakan juga proses yang menimbulkan beberapa efek pada faktor lingkungan kehidupan manusia, seperti kemungkinan pencairan gunung-gunung es yang akan menenggelamkan beberapa bagian daratan, perubahan iklim yang berakibat pada kelangkaan pangan penduduk. Lanjutan akibat yang perlu diperhitungkan adalah terjadinya migrasi penduduk bumi seperti yang terjadi pada zaman es di masa purbakala dengan potensi kekacauan sosial umat manusia secara global.
Meningkatnya suhu permukaan bumi akan mengakibatkan adanya perubahan iklim yang sangat ekstrim di bumi. Hal ini dapat mengakibatkan terganggunya hutan dan ekosistem lainnya, sehingga mengurangi kemampuannya untuk menyerap karbon dioksida di atmosfer. Pemanasan global mengakibatkan mencairnya gunung-gunung es di daerah kutub yang dapat menimbulkan naiknya permukaan air laut. Efek rumah kaca juga akan mengakibatkan meningkatnya suhu air laut sehingga air laut mengembang dan terjadi kenaikan permukaan laut yang mengakibatkan negara kepulauan akan mendapatkan pengaruh yang sangat besar.
Menurut perhitungan simulasi, efek rumah kaca telah meningkatkan suhu rata-rata bumi 1-5°C. Bila kecenderungan peningkatan gas rumah kaca tetap seperti sekarang akan menyebabkan peningkatan pemanasan global antara 1,5-4,5°C sekitar tahun 2030. Dengan meningkatnya konsentrasi gas CO2 di atmosfer, maka akan semakin banyak gelombang panas yang dipantulkan dari permukaan bumi diserap atmosfer. Hal ini akan mengakibatkan suhu permukaan bumi menjadi meningkat.
Hidrokarbon dapat diklasifikasikan menurut macam-macam ikatan karbon yang dikandungnya. Hidrokarbon dengan karbon-karbon yang mempunyai satu ikatan dinamakan hidrokarbon jenuh. Hidrokarbon dengan dua atau lebih atom karbon yang mempunyai ikatan rangkap dua atau tiga dinamakan hidrokarbon tidak jenuh (Fessenden, 1997).
Hidrogen dan senyawa turunannya, umumnya terbagi menjadi tiga kelompok besar yaitu:
1. Hidrogen alifatik terdiri atas rantai karbon yang tidak mencakup bangun siklik. Golongan ini sering disebut sebagai hidrokarbon rantai terbuka atau hidrokarbon siklik. Contoh hidrokarbon alifatik yaitu :
C2H6 (etana) CH3CH2CH2CH2CH3 (pentana)
2. Hidrokarbon alisiklik atau hidrokarbon siklik terdiri atas atom karbon yang tersusun dalam satu lingkar atau lebih.
3. Hidrokarbon aromatik merupakan golongan khusus senyawa siklik yang biasanya digambarkan sebagai lingkar enam dengan ikatan tunggal dan ikatan rangkap bersilih–ganti. Kelompok ini digolongkan terpisah dari hidrokarbon asiklik dan alifatik karena sifat fisika dan kimianya yang khas (Syukri, 1999).
Sebagai hidrokarbon jenuh, semua atom karbon dalam alkana mempunyai empat ikatan tunggal dan tidak ada pasangan elektron bebas. Semua elektron terikat kuat oleh kedua atom. Akibatnya, senyawa ini cukup stabil dan disebut juga parafin yang berarti kurang reaktif (Wilbraham, 1992).
Karbon-karbon dari suatu hidrokarbon dapat bersatu sebagai suatu rantai atau suatu cincin. Hidrokarbon jenuh dengan atom-atomnya bersatu dalam suatu rantai lurus atau rantai yang bercabang diklasifikasikan sebagai alkana. Suatu rantai lurus berarti dari tiap atom karbon dari alkana akan terikat pada tidak lebih dari dua atom karbon lain. Suatu rantai cabang alkana mengandung paling sedikit sebuah atom karbon yang terikat pada tiga atau lebih atom karbon lain (Fessenden, 1997).
Alkana rantai lurus:
CH3 – CH2 - CH3
Alkana rantai cabang :
CH3 – CH – CH2 – CH3
CH3
Senyawa berbobot molekul rendah berwujud gas dan cair, dan zat yang berbobot molekul tinggi berwujud padat. Alkana merupakan zat nonpolar, zat yang tak larut dalam air dengan kerapatan zat cair kurang dari 1,0 g/ml. Selain alkana juga ada alkena yaitu hidrokarbon yang memiliki satu atau lebih ikatan rangkap dua karbon–karbon. Senyawa ini dikatakan tidak jenuh karena tidak mempunyai jumlah maksimum atom yang sebetulnya dapat ditampung oleh setiap karbon (Pettruci, 1987).
Hidrokarbon alifatik berasal dari minyak bumi sedangkan hidrokarbon aromatik dari batu bara. Semua hidrokarbon, alifatik dan aromatik mempunyai tiga sifat umum, yaitu tidak larut dalam air, lebih ringan dibanding air dan terbakar di udara (Wilbraham, 1992)
Alkana yang merupkan hidrokarbon tak jenuh yang berasal dari aldehid dapat direaksikan dengan asetaldehid, logam Zn dan dalam suasana asam ditambahkan H2SO4, setelah dilakukannya penambahan H2SO4 maka terjadi perubahan warna berubah menjadi coklat kehitaman, pekat logam Zn yang adapun menjadi larut akibat pengaruh H2SO4. Reaksi ini dinamakan Reduksi Clemensen, adapun reaksinya sebagai berikut:
O
CH3 – C – H Zn + H2SO4 C2H6
Logam Zn disini berfungsi sebagai reduktor, sedangkan H2SO4 pekat berfungsi sebagai oksidator. Hal inilah yang menyebabkan terjadinya perubahan warna. Asetaldehid merupakan golongan dari aldehid yang mudah tereduksi menjadi senyawa dengan jumlah atom yang sama banyaknya. Logam Zn yang ditambahkan berfungsi sebagai reduktor (mengalami oksidasi), sedangkan larutan H2SO4 pekat sebagai oksidator (mengalami reduksi).
misi gas yang mempunyai pengaruh terhadap kesehatan manusia dan juga pemanasan global seringkali tidak merupakan prioritas dalam setiap kebijakan yang dibuat oleh banyak negara di dunia. Sebenarnya seberapa parahkah akibat yang ditimbulkan emisi gas ini dapat kita telusuri berikut ini.
Sejatinya, emisi gas yang berasal dari hasil bakaran dalam kegiatan manusia merupakan konsekuensi kehidupan sehari-hari di planet bumi ini. Emisi gas yang terjadi, pun bukan semata-mata berasal dari kegiatan manusia, tapi juga dari proses alami. Misalnya, pada pernafasan daun, letusan gunung berapi, proses kehidupan alamiah di hutan, kebakaran spontan dalam hutan, dan proses biokimia yang terjadi di rawa. Gas yang diemisikan secara alami ini, menurut Dr. dr. Rachmadhi Purwaka SKM dari Fakultas Kesehatan Masyarakat Universitas Indonesia, Jakarta, merupakan bagian dari proses daur ulang yang selalu terjadi secara dinamik dalam rangka menuju keseimbangan alamiah.
“Selama jumlah emisi gas hasil bakaran itu masih dalam batas-batas kesanggupan alam mendaur-ulangkan kembali, emisi gas tidak akan mengganggu secara nyata kehidupan di bumi. Namun, apabila peningkatan gas akibat kegiatan manusia telah melampau kepasitas daur ulang alami, tentu saja menyebabkan penumpukan gas, tidak hanya pada lingkungan mikro, tetapi juga telah menyebabkan goyahnya keseimbangan lingkungan makro, di antaranya dalam bentuk pemanasan global yang secara tidak langsung berakibat pada kesehatan masyarakat,” ungkap Rachmadhi.
Di samping efek gas yang tidak langsung itu, jenis-jenis kandungan gas emisi itu pun berpotensi menimbulkan akibat secara langsung terhadap kesehatan masyarakat.
Kehadiran beberapa komponen gas emisi yang terbentuk dari kendaraan bermotor (gas karbon monoksida, gas nitrogen, dan gas gas-gas nitrogen oksida, serta gas-hidrokarbon) dan ini merupakan bahan xenobiotic (zat asing bagi tubuh manusia), juga menimbulkan berbagai macam gangguan kesehatan pada manusia secara langsung. Karbon monoksida, misalnya, akan menimbulkan gangguan pada sistem pengangkutan oksigen dalam tubuh. Gas-gas nitrogen oksida merupakan gas yang berpotensi menurunkan imunitas tubuh, dan gas-gas hidrokarbon, jelas dapat menimbulkan iritasi, gangguan sistem tubuh dan kanker.
Pemanasan Global
Menurut Rachmadhi, pemanasan global mulai disadari ketika kira-kira pada dekade 1960-an sampai 1970-an, para ahli dihadapkan dengan data mengenai terhentinya pendinginan udara. Sebelumnya, bumi mengalami pendinginan dengan laju setengah derajat setiap tahunnya. Tetapi, proses pemanasan global yang ketika itu terdeteksi di belahan bumi bagian utara, menyebabkan proses pendinginan bumi terhenti. Sejak itu, kondisi ini berlanjut dengan pemanasan global yang menjurus kepada peningkatan suhu udara.
Para ahli yang tergabung dalam badan the National Oceanographic and Atmospheric Administration di Amerika Serikat, lalu percaya bahwa pemanasan global terjadi akibat penumpukan gas karbon dioksida di atmosfir lapisan atas sebagai hasil bakaran dalam kegiatan manusia. Kehadiran gas karbon dioksida dalam jumlah yang banyak ini seakan menjadi peredam bagi albedo atau derajat refleksi bumi terhadap sinar matahari yang memungkinkan bumi terhindar dari panas yang berlebihan. Refleksi bumi terhadap sinar matahari itu terjadi karena pemantulan sinar matahari oleh partikel-partikel debu, awan, permukaan air, hamparan salju, dan es.
Di samping gas karbon dioksida, beberapa gas lain juga diketahui turut dalam pemanasan global itu. Gas-gas yang dimaksud, antara lain, gas ozon yang terdapat pada atmosfir lapisan bawah, gas metana, gas-gas klorofluorokarbon, gas-gas nitrogen oksida, dan uap air. Awan yang merupakan penangkis sinar matahari pemanas bumi, ternyata juga menghalangi pelepasan panas yang dipantulkan bumi sehingga turut berperan dalam proses pemanasan global.
Menurut Rachmadhi, diketahui bahwa karbon dioksida mempunyai kontribusi terbesar dalam pengaruhnya terhadap pemanasan global, yaitu sebanyak 49 persen, sedangkan gas metana hanya 18 persen, gas-gas klorofluorokarbon 14 persen, gas-gas nitrogen oksida 6 persen, dan gas-gas lainnya sebesar 13 persen. Dengan demikian, dapat dikatakan bahwa dari segala macam gas penyebab terjadinya pemanasan global, gas karbon dioksida merupakan gas yang paling membahayakan. Sebaliknya, pemanasan global oleh gas karbon dioksida melalui greenhouse effect itu, merupakan prakondisi bagi kehidupan manusia dan kebanyakan hewan. Seandainya proses ini tidak terjadi, suhu rata-rata udara di permukaan bumi adalah minus 20 derajat Celcius.
Namun, dalam periode waktu belakangan ini, bumi mendapat pasokan berlebihan gas-gas itu. Pembakaran hutan dan bahan bakar fosil, kegiatan industri, pembangkit tenaga, dan emisi kendaraan bermotor mengkontribusikan gas karbon dioksida dan gas-gas lainnya ke atmosfir. “Pemasokan gas-gas ini terjadi secara berlebihan dan terkonsentrasi pada tempat-tempat tertentu”, tegasnya.
Akibat Adanya Peningkatan Jumlah Manusia dan Pembangunan
Peningkatan jumlah manusia dan aselerasi pembangunan yang mengiringinya, menimbulkan tuntutan tersedianya bahan pangan yang berlipat-lipat kali banyak dibanding masa-masa lalu. Pola bercocok tanam tradisional tidak sanggup lagi memenuhi desakan kebutuhan pangan dunia, sehingga pola pertanian mengalami revolusi yang memaksa terjadinya penebasan hutan untuk keperluan lahan bercocok tanam dan tempat hunian.
Dengan pembukaan lahan pertanian yang menyebabkan dibongkarnya hutan penyerap gas karbon dioksida melalui proses asimilasi, peningkatan kadar gas karbon dioksida di atmosfir menjadi lebih tak terkendali. Dalam keadaan biasa hutan dan tumbuhan pada umumnya merupakan salah satu unsur yang berperan mentranformasikan gas karbon dioksida menjadi bahan-bahan keperluan pertumbuhan bagi tanaman dalam daur-ulang karbon. “Menurut perkiraan, bila kondisi lain mendukung, diperlukan tanaman 20 milyar pohon setiap tahun untuk dapat menyerap 67 persen emisi tahunan gas karbondioksida di Amerika Serikat,” katanya.
Di samping karbon dioksida, gas-gas klorofluorokarbon, yang merupakan kelompok gas buatan manusia, juga mempunyai pengaruh terhadap dalam pemanasan global. Gas-gas klorofluorokarbon bukan merupakan emisi gas hasil bakaran kegiatan manusia. Kelompok gas ini dibuat untuk beberapa keperluan, di antaranya, sebagai bahan pendingin (diklorodifluorometana atau freon), bahan pelarut dalam industri, bahan pencuci komponen elektronik, bahan tambahan pada cat yang mudah menguap, bahan pembuatan karet busa plastik (karet busa poliuretana), dan tabung semprot aerosol. “Walaupun jumlah gas klorofluorokarbon jauh lebih sedikit daripada jumlah gas karbon dioksida, setiap molekul gas klorofluorokarbon berpotensi menimbulkan greenhouse effect sebesar 10 ribu kali dibandingkan dengan molekul gas karbon dioksida,” tegasnya.
Sekali masuk ke atmosfer, gas klorofluorokarbon dapat bertahan antara 75 tahun sampai dengan 110 tahun. Sementara berada di sana, gas ini akan beraksi melenyapkan gas ozon perisai pelindung bumi terhadap sinar matahari berlebihan. Akibat kelebihan sinar matahari ini berpengaruh terhadap timbulnya perubahan-perubahan pada iklim, kehidupan satwa dan flora. Fitoplankton dan algae bahan makanan untuk ikan dimatikan oleh sinar matahari berlebih ini. Akibatnya, penyerapan gas kardon dioksida oleh banyaknya flora air yang mati ini pun turut berkurang.
Pemanasan global berlebihan merupakan juga proses yang menimbulkan beberapa efek pada faktor lingkungan kehidupan manusia, seperti kemungkinan pencairan gunung-gunung es yang akan menenggelamkan beberapa bagian daratan, perubahan iklim yang berakibat pada kelangkaan pangan penduduk. Lanjutan akibat yang perlu diperhitungkan adalah terjadinya migrasi penduduk bumi seperti yang terjadi pada zaman es di masa purbakala dengan potensi kekacauan sosial umat manusia secara global.
Meningkatnya suhu permukaan bumi akan mengakibatkan adanya perubahan iklim yang sangat ekstrim di bumi. Hal ini dapat mengakibatkan terganggunya hutan dan ekosistem lainnya, sehingga mengurangi kemampuannya untuk menyerap karbon dioksida di atmosfer. Pemanasan global mengakibatkan mencairnya gunung-gunung es di daerah kutub yang dapat menimbulkan naiknya permukaan air laut. Efek rumah kaca juga akan mengakibatkan meningkatnya suhu air laut sehingga air laut mengembang dan terjadi kenaikan permukaan laut yang mengakibatkan negara kepulauan akan mendapatkan pengaruh yang sangat besar.
Menurut perhitungan simulasi, efek rumah kaca telah meningkatkan suhu rata-rata bumi 1-5°C. Bila kecenderungan peningkatan gas rumah kaca tetap seperti sekarang akan menyebabkan peningkatan pemanasan global antara 1,5-4,5°C sekitar tahun 2030. Dengan meningkatnya konsentrasi gas CO2 di atmosfer, maka akan semakin banyak gelombang panas yang dipantulkan dari permukaan bumi diserap atmosfer. Hal ini akan mengakibatkan suhu permukaan bumi menjadi meningkat.
Tata Nama Senyawa Hidrokarbon
1. Alkana
Alkana merupakan senyawa hidrokarbon yang ikatan rantai karbonnya tunggal. Rumus umum alkana adalah CnH2n + 2.
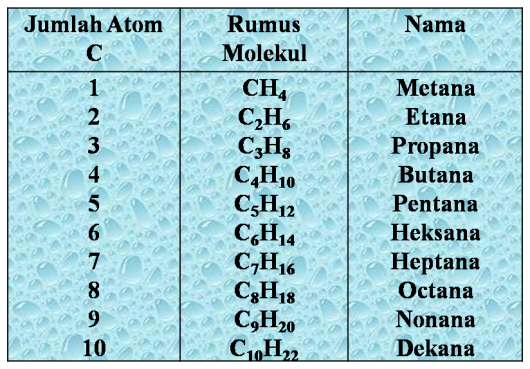
Tata nama alkana menurut IUPAC
1) Alkana rantai lurus diberi nama dengan awalan n
(n = normal).
Contoh:
CH3-CH2-CH2-CH3 n-butana
CH3-CH2-CH2-CH2-CH3 n-pentana

2. Alkena
Alkena merupakan senyawa hidrokarbon yang mempunyai ikatan rangkap dua pada rantai karbonnya. Rumus umum alkena adalah CnH2n.

Tata Nama Alkena dengan C1 – C3
Sama dengan nama yang terdapat pada deret homolog
Ex : C2H4 = etena
C3H8 = propena
Tata nama Alkena Rantai Lurus(C4 – ….)
IUPAC telah menetapkan aturan penamaan Alkena rantai lurus dengan menuliskan nomor C yang mempunyai ikatan rangkap diikuti dengan nama alena sesuai dengan jumlah atom C ( berdasarkan Deret homolog
Atom C yang mempunyai ikatan rangkap harus diberi nomor sekecil mungkin
Ex : C4H8
1 2 3 4
CH2 = CH – CH2 – CH3 = 1 – butena
C6H12
6 5 4 3 2 1
CH3 – CH2 – CH2 – CH = CH – CH3 = 2 – heksena

3. Alkuna
Alkuna merupakan senyawa hidrokarbon yang mempunyai
ikatan rangkap tiga pada rantai karbonnya. Rumus umum
alkuna adalah CnH2n – 2.
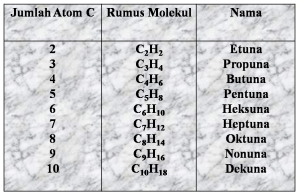
Tata Nama Alkuna dengan C1 – C3
Sama dengan deret homolog
Ex : C2H4 = etuna
C3H8 = propuna
B. Tata nama Alkuna Rantai Lurus(C4 – ….)
IUPAC telah menetapkan aturan penamaan Alkuna rantai lurus dengan menuliskan nomor C yang mempunyai ikatan rangkap tiga diikuti dengan nama alkuna sesuai dengan jumlah atom C ( berdasarkan Deret homolog
Atom C yang mempunyai ikatan rangkap harus diberi nomor sekecil mungkin
Ex : C4H8
1 2 3 4
CH CH – CH2 – CH3 = 1 – butuna
C6H12
6 5 4 3 2 1
CH3 – CH2 – CH2 – C C – CH3 = 2 – heksuna
Tata nama alkuna menurut IUPAC
1) Rantai induk diambil rantai karbon terpanjang yang
mengandung ikatan rangkap tiga. Ikatan rangkap tiga
diberi nomor sekecil mungkin.
2) Rantai cabang diberi nomor menyesuaikan nomor
ikatan rangkap tiga.
Alkana merupakan senyawa hidrokarbon yang ikatan rantai karbonnya tunggal. Rumus umum alkana adalah CnH2n + 2.

Tata nama alkana menurut IUPAC
1) Alkana rantai lurus diberi nama dengan awalan n
(n = normal).
Contoh:
CH3-CH2-CH2-CH3 n-butana
CH3-CH2-CH2-CH2-CH3 n-pentana

2. Alkena
Alkena merupakan senyawa hidrokarbon yang mempunyai ikatan rangkap dua pada rantai karbonnya. Rumus umum alkena adalah CnH2n.

Tata Nama Alkena dengan C1 – C3
Sama dengan nama yang terdapat pada deret homolog
Ex : C2H4 = etena
C3H8 = propena
Tata nama Alkena Rantai Lurus(C4 – ….)
IUPAC telah menetapkan aturan penamaan Alkena rantai lurus dengan menuliskan nomor C yang mempunyai ikatan rangkap diikuti dengan nama alena sesuai dengan jumlah atom C ( berdasarkan Deret homolog
Atom C yang mempunyai ikatan rangkap harus diberi nomor sekecil mungkin
Ex : C4H8
1 2 3 4
CH2 = CH – CH2 – CH3 = 1 – butena
C6H12
6 5 4 3 2 1
CH3 – CH2 – CH2 – CH = CH – CH3 = 2 – heksena

3. Alkuna
Alkuna merupakan senyawa hidrokarbon yang mempunyai
ikatan rangkap tiga pada rantai karbonnya. Rumus umum
alkuna adalah CnH2n – 2.

Tata Nama Alkuna dengan C1 – C3
Sama dengan deret homolog
Ex : C2H4 = etuna
C3H8 = propuna
B. Tata nama Alkuna Rantai Lurus(C4 – ….)
IUPAC telah menetapkan aturan penamaan Alkuna rantai lurus dengan menuliskan nomor C yang mempunyai ikatan rangkap tiga diikuti dengan nama alkuna sesuai dengan jumlah atom C ( berdasarkan Deret homolog
Atom C yang mempunyai ikatan rangkap harus diberi nomor sekecil mungkin
Ex : C4H8
1 2 3 4
CH CH – CH2 – CH3 = 1 – butuna
C6H12
6 5 4 3 2 1
CH3 – CH2 – CH2 – C C – CH3 = 2 – heksuna
Tata nama alkuna menurut IUPAC
1) Rantai induk diambil rantai karbon terpanjang yang
mengandung ikatan rangkap tiga. Ikatan rangkap tiga
diberi nomor sekecil mungkin.
2) Rantai cabang diberi nomor menyesuaikan nomor
ikatan rangkap tiga.

POLIMER
- 1. Kimia
- 2. Terdiri dari kata poly =banyak; mer = bagian. Yang artinya suatu molekul raksasa (makromolekul) yang tersusun dari monomer-monomernya.
- 3. 1.Asalnya 2.Jenismonomerny a 3.Sifatkekenyalanny a
- 4. 1.Berdasarkan asalnyaPolimer Alam adalah polimer yang telah tersedia di alam dan terbentuk secara alami.Contoh: Karet alam (poliisoprena) Polimer Sintesis/Buatanyaitu polimer yang disintetik dan tidak terdapat di alam. Misalnya polietena, polipropilena, polivinilklorida Polimer polietilen, nilon, teflon. (PVC),SemisintesisYaitu diperoleh dari hasil modifikasi polimer alam dan bahan kimia.contoh: selulosa nitrat.
- 5. 2. Berdasarkan Monomernya1.Homopolimer:monome rnya sama. Strukturnya adalah:——A – A – A – A – A — —2. Kopolimer:monomerberbeda.Strukturnya adalah:—A – B – A – B – A – B
- 6. 3.Berdasarkan Sifat Kekenyalannyaa. Polimer termoplastik, yaitupolimer yang bersifat kenyal(liat) apabila dipanaskan dandapat dibentuk menurutkehendak kita.b. Polimer termoset, yaitu polimeryang pada mulanya kenyal ketikadipanaskan, tetapi sekali didinginkantidak dapat dilunakkan lagi sehinggatidak dapat diubah menjadi bentuk
- 7. Tabel perbedaan sifat plastik termoplas dan plastik termoset Plastik termoplas Plastik termosetMudah direnggangkan Keras dan rigidFleksibel Tidak fleksibelMelunak jika dipanaskan Mengeras jika dipanaskanTitik leleh rendah Tidak meleleh jika dipanaskanDapat dibentuk ulang Tidak dapat dibentuk ulang
- 8. Reaksi Pembentukan Polimer (Polimerisasi)1. Polimerisasi Adisi adalah polimer yang terbentuk dari reaksi polimerisasi disertai dengan pemutusan ikatan rangkap diikuti oleh adisi dari monomer-monomernya yang membentuk ikatan tunggal.
- 9. Polimer yang terbentuk hanya mengandung satu macam monomer: homopolimer. Dapat berlangsung dengan bantuan katalisator. Contoh: pembentukan polietilena dari etena. CH2 = CH2 + CH2 = CH2 → –CH2–CH2–CH2–CH2 – → (–CH2–CH2–)n 2 monomer dimer polimer
- 10. 2.Polimerisasi Kondensasi adalah reaksi antara dua gugus fungsional pada molekul-molekul monomer yang berinteraksi membentuk polimer dengan melepaskan molekul kecil (H2O, NH3).
- 11. Contoh: nilon 66
- 12. 1.Polietilen a 2.Polipropilen a 3.PV C 4.Teflon 5.Polistiren a 6.PVA 7.Bakelit 8.Karet Alam 9.Karet Sintesis
- 13. 1. Polietilena Polietilena merupakan polimer yang terbentuk dari polimerisasi adisi etena. nCH2 = CH2 ( -CH2-CH2 -)n- etena polietilena Sifat-sifat dan kegunaan polietilena adalah: 1) titik leleh 110°C, 2) melunak dalam air panas, 3) digunakan untuk botol
- 14. 2. Polipropilena Polipropilena tersusun dari molekul-molekul propena. nCH2 = CH-CH3 (-CH2- CH- )n CH3 propena polipropilena Polipropilena digunakan untuk membuat tali, botol, karung
- 15. 3. PVC Tersusun dari vinil klorida melalui polimerisasi adisi. nCH2 = CH ( -CH2- CH- )n Cl Cl vinil klorida polivinilklorida Bersifat keras, kaku, dan mudah rusak digunakan untuk membuat pipa, tongkat, dan pelapis lantai.
- 16. 4. Teflon (PTFE) tersusun dari monomer-monomer tetrafluorotena. n CF2 = CF2 ( -CF2-CF2- )n Tetrafluoroetena teflon bersifat sangat ulet,kenyal, tahan terhadap zat kimia,tak mudah terbakar, isolator listrik yang baik, dan mampu melumasi diri serta tidak menempel
- 17. Sifat dan kegunaan teflon adalah 1) titik leleh 327°C, 2) tahan terhadap panas, 3) tahan terhadap zat kimia, digunakan untuk alat-alat yang tahan terhadap bahan kimia, misalnya pelapis tangki bahan kimia, pelapis panci anti lengket.
- 18. 5. Polistirena tersusun atas monomer stirena CH = CH2 → ( -CH-CH2- )n O O stirena polistirena untuk membuat gelas minuman ringan, isolasi, dan untuk kemasan makanan.
- 19. 6. PVA tersusun dari monomer-monomer vinil asetat. n CH2 = CH ( -CH2- CH- )n O O C=O C=O CH3 CH3 vinil asetat PVA (polivinil asetat) PVA digunakan untuk pengemulsi cat.
- 20. 7. Bakelittersusun dari fenol dan formaldehid.digunakan untuk pembuatan peralatan listrik.
- 21. 8.Karet Alam tersusun dari monomer-monomer isoprena atau 2 metil 1,3 betadiena. bersifat lunak, lekat, dan mudah dioksidasi Karet diekstraksi dari lateks (getah pohon karet), hasil vulkanisirnya digunakan untuk ban kendaraan.
- 22. 9.Karet Sintesis 1) Neoprena (Kloroprena) tersusun dari monomer-monomer 2 kloro1,3 butadiena. Sifat dan kegunaan neoprena adalah tahan terhadap bensin, minyak. tanah, dan lemak sehingga digunakan untuk membuat selang
- 23. 2.Karet Nitril tersusun dari monomer butadiena dan akrilonitril. sifat tahan terhadap bensin, minyak dan lemak, digunakan untuk membuat selang. 3) SBR SBR (Styrena Butadiena Rubber) tersusun dari monomer stirena dan butadiena.
- 24. 1.Pengumpulan2.Pemisahan3.Pelelehan4.PembentukanUlang
- 25. *adalah teknologi pengolahan sampahyang melibatkan pembakaran bahanorganik.*Incinerasi material sampah mengubahsampah menjadi abu, gas sisa hasilpembakaran, partikulat,dan panas.*Panas yang dihasilkan bisadimanfaatkan sebagai energi pembangkitlistrik.*Incinerasi dengan energy recoveryadalah salah satu teknologi sampah-ke-energi (waste-to-energy, WtE).
- 26. PlastikBiodegradabel -Kebanyakan berbahan dasar tepung -Mahal
ANALISIS GRAVIMETRI
Percobaan analisis gravimetri ini
bertujuan untuk menentukan Cu dalam Tembaga Sulfat Pentahidrat, menentukan
jumlah besi sebagai besi (III) oksida serta memahami prosedur dan aplikasi
metode gravimetri dalam suatu teknik analisis. Gravimetri dibagi menjadi dua
metode, yaitu metode pengendapan dan penguapan. Prinsip percobaan ini adalah
berdasarkan hasil kali kelarutan yaitu dengan mereaksikan CuSO4.5H2O
dengan H2SO4 sehingga terbentuk endapan CuSO4
dan mereaksikan Fe dengan 2 HCl sehingga dapat menentukan jumlah Fe(III)
oksida.
6.1. Menentukan
Cu dalam tembaga sulfat pentahidrat
Tujuan percobaan adalah penentuan kadar Cu dalam
tembaga sulfat pentahidrat. Adapun metode yang digunakan adalah metode
gravimetri dengan cara penguapan, dimana produk yang dihasilkan berupa endapan
yang kemudian dicuci, dikeringkan, untuk selanjutnya ditimbang. Dengan faktor
stoikiometri, kadar tembaga tersebut dapat dihitung.
CuSO4.5H2O merupakan suaru
senyawa yang mempunyai 5 molekul H2O, empat terikat secara kovalen
koordinasi dan satu terikat dengan H2O kompleks secara ikatan
hydrogen. H2O yang satu ini terikat sebagai hidrat, yang empat lagi
berikatan kovalen koordinasi, karena itu energy ikatannya lebih tinggi dari
pada H2O yang terikat sebagai hidrat.
CuSO4.5H2O di tambahkan dengan H2SO4,
penambahan H2SO4 ini bertujuan agar Cu cepat larut.
Larutan menjadi berwarna biru, kemudian di panaskan. Pemanasan ini bertujuan
untuk mempercepat reaksi pelarutan logam Zn dengan penutupan beker menggunakan
gelas arloji, dan pembukaan gelas arloji sebelum pengadukan bertujuan agar gas
yang dihasilkan selama pemanasan dapat keluar sehinngga mengurangi tekanan pada
gelas beker. Reaksi yang terjadi:
CuSO4.5H2O + H2SO4
→ CuSO4(aq) + SO2 ↑ + H2O↑
Kemudian ditambah dengan logam Zn. Penambahan logam Zn ini bertujuan
untuk mengubah ion tembaga dalam larutan menjadi logam tembaga. Dalam hal ini
terjadi reaksi redoks antara Cu dan Zn. Reaksi yang terjadi:
Zn(s) + CuSO4(aq) → Cu(s)
+ ZnSO4(aq)
Zn akan teroksidasi menjadi Zn2+ sedangkan Cu2+
terduksi menjadi Cu. Zn sebagai reduktor dan Cu sebagai oksidator. Cu mengalami
reduksi karena potensial reduksi Cu cenderung lebih besarvdibandingkan Zn,
sehingga agar berlangsung reaksi spontan Zn akan mengalami oksidasi :
Cu2+ + 2e → Cu E0 = 0,15
Zn2+ + 2e → Zn E0 = - 0,26
Dengan adanya Zn maka Cu akan terpisah dan Zn larut membentuk ZnSO4.
dalam larutan terbentuk endapan merah bata. Endapan ini menandakan adanya logam
Cu. Pada saat pemanasan, gelas beker di tutup dengan gelas arloji kemudian
setelah beberapa menit di buka dan di aduk agar endapan yang terbentuk tidak
kasar. Pemanasan ini dilakukan hingga larutan menjadi tak berwarna. Setelah itu
sampel tersebut di cuci dengan aquades. Hal ini bertujuan untuk menghilangkan
pengotor-pengotor yang bersifat polar. Kemudian dicuci dengan aseton untuk
menghilangkan pengotor-pengotor yang bersifat nonpolar. Setelah itu dilakukan
evaporasi untuk menghilangkan sisa aseton. Kemudian ditambahkan HCl encer untuk
mencegah terendapkannya air sadah pada endapan Cu karena dapat menyebabkan
endapan Cu tidak murni. Dari hasil percobaan diperoleh massa endapan Cu gram dan rendemen sebesar Randemen nyata selalu lebih kecil
daripada randemen teoritis karena pada randemen nyata masih terdapat
pengotor-pengotor pada endapan yang diperoleh.
6.2. Menentukan besi sebagai besi (III) Oksida
Percobaan ini bertujuan untuk menentukan besi sebagai
besi (III) oksida. Untuk percobaan ini digunakan metode gravimetri dengan cara
pengendapan, yaitu mengendapkan suatu campuran besi dengan pelarut untuk
mengendapkan besi murni.
Penambahan HCl berfungsi untuk melarutkan besi (II)
dan gas hidrogen. Reaksinya:
Fe + 2H+ → Fe 2+ + H2↑
Fe + 2 HCl → Fe 2+ + 2 Cl- + H2 ↑
Sedangkan fungsi HNO3 dalam reaksi adalah untuk melarutkan
besi (Fe) dengan membentuk gas nitrogen dan ion besi, selain itu HNO3
juga berfungsi unutk mengoksidasi Fe menjadi Fe 3+. Reaksinya :
Fe + HNO3 + 3 H+
→ Fe 3+ + NO ↑+ 2H2O
Penambaahan HNO3 pekat dan HCl menyebabkan
terjadinya perubahan warna larutan menjadi kuning pekat. Setelah itu didihkan
untuk mempercepat reaksi . Pada saat pemanasan larutan menjadi kuning jernih.
Dalam keadaan panas ditambahkan lagi larutan ammonia. Penambahan ammonia ini
bertujuan untuk membentuk endapan Fe atau memisahkan Fe dalam bentuk endapan
berwarna coklat yang menandakan adanya logam Fe.
Reaksi:
Fe 2+ + 2 OH-
→ Fe (OH)3a
Fe (OH)3 → Fe2O3 + 3 H2O
Hukum Hess
Hukum Hess
Hukum ini diajukan oleh Germain Hess, dia menyatakan bahwa entalphi reaksi (ΔH) hanya tergantung pada keadaan awal reaksi dan hasil reaksi dan tidak bergantung pada jalannya reaksi.

Jika suatu reaksi merupakan penjumlahan aljabar dari dua atau lebih reaksi, maka perubahan entalphi (ΔH) atau kalor reaksinya juga merupakan penjumlahan aljabar dari (ΔH) yang menyertai reaksi. Untuk lebih mudah memahaminya kita perhatikan Bagan 10.17.

Bagan 10.17. Penjumlahan aljabar reaksi dan entalphi menurut Germain Hess
Berdasarkan persamaan reaksi gas karbon dioksida dapat terbentuk melalui dua tahap, yang pertama pembentukan karbonmonoksida dari unsur-unsurnya dan dilanjutkan dengan oksidasi dari karbonmonoksida menjadi karbondioksida.
Penjumlahan aljabar ΔHreaksi dari setiap tahap reaksi juga dilakukan sesuai dengan tahap reaksi, maka ΔHreaksi dari pembentukan gas Karbon dioksida juga dapat dilakukan.
Berdasarkan berbagai jenis reaksi, maka kita juga dapat mengembangkan jenis kalor reaksi atau ΔH yang disesuaikan dengan jenis reaksinya, ada empat jenis kalor reaksi yaitu kalor reaksi pembentukan, penguraian, pembakaran dan pelarutan. Keempat klasifikasi tersebut disederhanakan dalam bagan pada Bagan 10.18.

Hukum ini diajukan oleh Germain Hess, dia menyatakan bahwa entalphi reaksi (ΔH) hanya tergantung pada keadaan awal reaksi dan hasil reaksi dan tidak bergantung pada jalannya reaksi.
Jika suatu reaksi merupakan penjumlahan aljabar dari dua atau lebih reaksi, maka perubahan entalphi (ΔH) atau kalor reaksinya juga merupakan penjumlahan aljabar dari (ΔH) yang menyertai reaksi. Untuk lebih mudah memahaminya kita perhatikan Bagan 10.17.

Bagan 10.17. Penjumlahan aljabar reaksi dan entalphi menurut Germain Hess
Berdasarkan persamaan reaksi gas karbon dioksida dapat terbentuk melalui dua tahap, yang pertama pembentukan karbonmonoksida dari unsur-unsurnya dan dilanjutkan dengan oksidasi dari karbonmonoksida menjadi karbondioksida.
Penjumlahan aljabar ΔHreaksi dari setiap tahap reaksi juga dilakukan sesuai dengan tahap reaksi, maka ΔHreaksi dari pembentukan gas Karbon dioksida juga dapat dilakukan.
Berdasarkan berbagai jenis reaksi, maka kita juga dapat mengembangkan jenis kalor reaksi atau ΔH yang disesuaikan dengan jenis reaksinya, ada empat jenis kalor reaksi yaitu kalor reaksi pembentukan, penguraian, pembakaran dan pelarutan. Keempat klasifikasi tersebut disederhanakan dalam bagan pada Bagan 10.18.

Elektrokimia
Keadaan standar didefinisikan sebagai keadaan pada 25o C
(298.15 K), pada keaktifan satu untuk semua zat dalam sel elektrokimia
pada sel dengan arus nol pada tekanan 1 bar (105 Pa). Untuk reaksi yang
melibatkan ion H+, keadaan standar adalah pH = 0 (sekitar konsentrasi asam 1 molar).
Dalam kasus elektrode hidrogen digunakan sebagai potensial elektrode standar, gas hidrogen 1 atm (aH2 = 1) dikontakkan perlahan dengan elektroda platinum-hitam yang dibenamkan dalam larutan asam kuat dengan keaktifan, aH+ = 1. Potentialnya diungkapkan sebagai:
 dan menurut definisi E0
= 0 dalam keadaan standar. Elektroda hidrogen dalam keadaan standar
disebut sebagai elektrode hidrogen standar atau NHE. Walaupun potensial
reduksi biasanya diungkapkan dengan rujukan NHE standar, elektrode
hidrogen sukar ditangani. Oleh karena itu elektrode kalomel jenuh atau
Ag/AgCl digunakan sebagai elektroda rujukan untuk pengukuran
elektrokimia sehari-hari dan potensial percobaan diukur terhadap
elektroda ini atau dikonversi pada nilai NHE. Bila nilai NHE diset
menjadi 0, nilai SCE 0.242 V, dan Ag/AgCl adalah 0.199 V.
dan menurut definisi E0
= 0 dalam keadaan standar. Elektroda hidrogen dalam keadaan standar
disebut sebagai elektrode hidrogen standar atau NHE. Walaupun potensial
reduksi biasanya diungkapkan dengan rujukan NHE standar, elektrode
hidrogen sukar ditangani. Oleh karena itu elektrode kalomel jenuh atau
Ag/AgCl digunakan sebagai elektroda rujukan untuk pengukuran
elektrokimia sehari-hari dan potensial percobaan diukur terhadap
elektroda ini atau dikonversi pada nilai NHE. Bila nilai NHE diset
menjadi 0, nilai SCE 0.242 V, dan Ag/AgCl adalah 0.199 V.
Reaksi redoks terjadi hanya bila pasangan redoks ada dan reaktannya dapat berupa oksidator atau reduktor bergantung pasangan reaksinya. Kemampuan relatif redoksnya dapat diungkapkan secara numerik dengan memberikan potensial reduksi setengah reaksinya, E0 (Tabel 3.1). Perubahan energi bebas reaksi berhubungan dengan E0,
 n adalah jumlah elektron yang diserahterimakan dan f adalah konstanta Faraday, 96500 C.mol-1.
n adalah jumlah elektron yang diserahterimakan dan f adalah konstanta Faraday, 96500 C.mol-1.
 Misalnya, untuk dua reaksi
Misalnya, untuk dua reaksi
![dua reaksi]](http://www.chem-is-try.org/wp-content/uploads/2009/08/dua-reaksi.JPG) Tidak berlangsung bebas, tetapi bila H+
(aq) dan Zn(s) ada, reaksi redoks akan berlangsung. Persamaan yang
menyatakan reaksi yang berlangsung didapat bila reaksi ke-2 dikurangi
dengan persamaan reaksi pertama
Tidak berlangsung bebas, tetapi bila H+
(aq) dan Zn(s) ada, reaksi redoks akan berlangsung. Persamaan yang
menyatakan reaksi yang berlangsung didapat bila reaksi ke-2 dikurangi
dengan persamaan reaksi pertama
 Perubahan energi bebas reaksi redoks keseluruhan adalah selisih perubahan energi masing-masing setengah reaksi.
Perubahan energi bebas reaksi redoks keseluruhan adalah selisih perubahan energi masing-masing setengah reaksi.
 Karena setengah sel pada dasarnya hanya imajiner dan umumnya digunakan sebagai pasangan, perubahan energi bebas ∆G01 untuk H+ diset 0. Dalam hal ini karena didapat hasil percobaan ∆G0 sebesar -147 kJ, maka ∆G02 bernilai 147 kJ. Potensial E0 yang berkaitan dengan ∆G0 setengah reaksi disebut potensial reduksi standar.
Karena setengah sel pada dasarnya hanya imajiner dan umumnya digunakan sebagai pasangan, perubahan energi bebas ∆G01 untuk H+ diset 0. Dalam hal ini karena didapat hasil percobaan ∆G0 sebesar -147 kJ, maka ∆G02 bernilai 147 kJ. Potensial E0 yang berkaitan dengan ∆G0 setengah reaksi disebut potensial reduksi standar.
 Maka
Maka
 Potensial
standar berbagai setengah reaksi ditentukan dengan menggunakan prosedur
yang mirip dengan yang disebutkan tadi (Tabel 3.1). E0 reaksi redoks dapat dihitung dengan mengkombinasikan E0 setengah reaksi ini.
Potensial
standar berbagai setengah reaksi ditentukan dengan menggunakan prosedur
yang mirip dengan yang disebutkan tadi (Tabel 3.1). E0 reaksi redoks dapat dihitung dengan mengkombinasikan E0 setengah reaksi ini.
Bila E0 reaksi redoks positif, ∆G0 bernilai negatif dan reaksi berlangsung spontan. Akibatnya selain menggunakan perubahan energi bebas potensial reduksi juga dapat digunakan untuk menentukan kespontanan reaksi. Semakin besar potensial reduksi semakin kuat kemampuan oksidasinya. Nilai positif atau negatif berdasarkan nilai potensial reduksi proton adalah 0, dan harus dipahami bahwa nilai positif tidak harus berarti mengoksidasi, dan nilai negatif bukan berarti mereduksi. Deretan yang disusun berdasarkan kekuatan redoks disebut deret elektrokimia.
Dalam kasus elektrode hidrogen digunakan sebagai potensial elektrode standar, gas hidrogen 1 atm (aH2 = 1) dikontakkan perlahan dengan elektroda platinum-hitam yang dibenamkan dalam larutan asam kuat dengan keaktifan, aH+ = 1. Potentialnya diungkapkan sebagai:
Reaksi redoks terjadi hanya bila pasangan redoks ada dan reaktannya dapat berupa oksidator atau reduktor bergantung pasangan reaksinya. Kemampuan relatif redoksnya dapat diungkapkan secara numerik dengan memberikan potensial reduksi setengah reaksinya, E0 (Tabel 3.1). Perubahan energi bebas reaksi berhubungan dengan E0,

Bila E0 reaksi redoks positif, ∆G0 bernilai negatif dan reaksi berlangsung spontan. Akibatnya selain menggunakan perubahan energi bebas potensial reduksi juga dapat digunakan untuk menentukan kespontanan reaksi. Semakin besar potensial reduksi semakin kuat kemampuan oksidasinya. Nilai positif atau negatif berdasarkan nilai potensial reduksi proton adalah 0, dan harus dipahami bahwa nilai positif tidak harus berarti mengoksidasi, dan nilai negatif bukan berarti mereduksi. Deretan yang disusun berdasarkan kekuatan redoks disebut deret elektrokimia.
SEL VOLTA (SEL GALVANI
1. Energi hasil dari reaksi kini dirubah menjadi energi listrik
2. Reaksi yang berlangsung adalah reaksi redoks
3. Pada katoda terjadi reduksi dan merupakan kutub positif
4. Pada anoda terjadi oksidasi dan merupakan kutub negatif
Jadi katoda positif, Anoda negatif disingkat KPAN yang dibaca KAPAN
KOMPONEN SEL VOLTA
Rangkaian sel elektrokimia pertama kali dipelajari oleh LUIGI GALVANI (1780) dan ALESSANDRO VOLTA (1800). Sehingga disebut sel Galvani atau sel Volta. Keduanya menemukan adanya pembentukan energi dari reaksi kimia tersebut. Energi yang dihasilkan dari reaksi kimia sel Volta berupa energi listrik

Sel Volta terdiri atas elektroda (logam seng dan tembaga) larutan elektrolit (ZnSO4 dan CuSO4), dan jembatan garam (agar-agar yang mengandung KCl). Logam seng dan tembaga bertindak sebagai elektroda. Keduanya dihubungkan melalui sebuah voltmeter. Elektroda tempat berlangsungnya oksidasi disebut Anoda (elektroda negatif), sedangkan elektroda tempat berlangsungnya reduksi disebut Katoda (elektroda positif)
Langganan:
Komentar (Atom)





